 Il termine atomo deriva dalla parola greca atomòs, indivisibile. I filosofi Democrito ed Epicuro affermarono per primi la sua esistenza; Ma fino al XVIII sec. quella dell'atomo rimase solo una dottrina filosofica. Il termine atomo deriva dalla parola greca atomòs, indivisibile. I filosofi Democrito ed Epicuro affermarono per primi la sua esistenza; Ma fino al XVIII sec. quella dell'atomo rimase solo una dottrina filosofica.
Solo con Avogadro e Dalton il concetto di atomo prese una connotazione scientifica, tuttavia non si aveva ancora idea riguardo le particelle che lo costituiscono. Dal XIX secolo in poi, furono eseguiti numerosi esperimenti per determinare molte proprietà della materia. Ma spesso fu possibile ricavare solo leggi empiriche di cui non era possibile dare una giustificazione.
Nel 1897, J.J.Thomson fu il primo ad avvicinarsi alla verità; dopo una lunga serie di esperimenti scoprí di aver scoperto una nuova particella: l'elettrone avente carica elettrica negativa. Sulla base delle sue scoperte egli realizzò un modello, secondo cui l´atomo era una sfera di raggio 10-10 m circa, contenente al suo interno gli elettroni, ed una massa positiva che bilanciasse la carica negativa degli stessi elettroni; teorizzò che l´atomo stesso fosse neutro, cioè non avesse nessuna carica. Il modello di Thomson era certamente il più veritiero fino ad allora elaborato, ma continuava a lasciare parecchi dubbi; nonostante questo, la maggioranza dei fisici si convinse che questa fosse la strada giusta.
Deciso a risolvere i dubbi rimasti, E. Ruherford incaricò due ricercatori di bombardare con delle particelle α, che oggi sappiamo essere composte da due protoni e due neutroni, un sottilissimo foglio d´oro. Le particelle avrebbero dovuto subire un leggera deflessione del loro moto rettilineo, nonchè una lieve perdita di velocità. Tramite il suo esperimento, Rutherford sperava di trovare delle misure più precise circa il modello teorizzato da Thomson, rilevabili tramite la misurazione della deflessione.
I risultati non furono esattamente quelli previsti: non solo le particelle α deviavano molto più di quanto teorizzato, ma spesso alcune invertivano addirittura il poprio moto. Questo fu il commento dello stesso Rutherford: Fu l'evento più incredibile che mi fosse mai capitato nella vita. Altrettanto incredibile come se vi fosse capitato di sparare un proiettile da quindici pollici su un pezzo di carta velina e questo fosse tornato indietro a colpirvi. Dopo un´ attenta analisi Rutherford osservò che l´atomo è composto da un nucleo caricato positivamente, di raggio circa 10-14m, intorno al quale sono distribuiti gli elettroni fino ad una distanza di circa 10-10-m . Il modello atomico di Thomson venne quindi sostituito da quello di Rutherford, ma anche questo lasciava problemi insoluti.
Fu un giovane fisico danese ad illuminare nel 1913 la strada verso la verità: Niels Bohor. Di ritorno dal laboratorio di Rutherford egli propose una soluzione al principale problema dei vari modelli atomici: quello degli elettroni che lo compongono. Stando vicino al nucleo, questi risentono dell'attrazione Coulombiana; se stessero fermi, questa forza di richiamo li farebbe accelerare, fino a collassare nel nucleo, ma ciò è impossibile, dato che la materia è stabile. Ma gli elettroni non potrebbero nemmeno muoversi, dato che in questo modo rilascerebbero energia cinetica sotto forma di onde elettromagnetiche. Se così avvenisse, l´elettrone perderebbe la sua energia in pochi miliardesimi di secondo, finendo comunque per collassare nel nucleo.
Come risolse dunque questo apparentemente insormontabile paradosso il giovane Bohor? Egli applicò ad alcuni concetti appresi presso il laboratorio di Rutherford le idee di quantizzazione introdotte da Planck ed ampliate da Einstain. Ipotizzè che gli elettroni si muovessero sì attorno al nucleo, ma secondo un moto simile a quello che della luna attorno alla terra (modello planetario), sostituendo l´ l´interazione gravitazionale con quella elettromagnetica. Dallo sviluppo di questo modello Bohr dedusse che gli elettroni atomici sono distribuiti a strati, nel senso che coprono orbite intorno al nucleo a diverse distanze (come i pianeti intorno al sole).
Il modello di Bohor, per quanto ormai vicinissimo alla realtà, lasciava ancora dei quesiti senza risposta. Lo sviluppo della comprensione dell'atomo crebbe esponenzialmente, fin tanto che nel 1932 J.Chadwick pose l'ultimo tassello nella costruzione definitiva del modello atomico, scoprendo il neutrone.
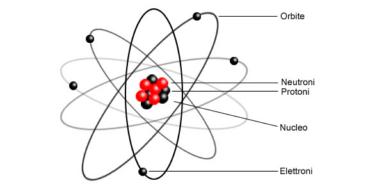
Oggi sappiamo che gli atomi sono composti da un nucleo molto piccolo (raggio 10-14m) composto da neutroni e protoni, circondato da una nuvola di elettroni che gli gira intorno fino ad una distanza di circa 10-10m. Neutroni e protoni sono tenuti insieme, vincendo la repulsione elettrica tra le cariche positive, grazie alle interazioni forti, mentre gli elettroni rimangono legati all'atomo a causa dell'interazione elettromagnetica. Esistono in natura circa un centinaio di tipi di atomi e ne vengono creati di nuovi nei moderni laboratori di fisica.
|
|
|

